| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | ||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 23 | 24 | 25 | 26 | 27 | 28 |
- Database
- 시스템
- 웹 크롤링
- 고전역학
- 자바네트워크
- oracle
- jpa
- 코틀린
- spring integration
- write by chatGPT
- NIO
- Java
- 리눅스
- 신재생에너지 발전설비 기사
- spring data jpa
- 데이터베이스
- 소프트웨어공학
- 역학
- 유닉스
- 자바암호
- JVM
- chatGPT's answer
- 자바
- write by GPT-4
- 인프라
- flet
- kotlin
- python
- GPT-4's answer
- 파이썬
- Today
- Total
기억을 지배하는 기록
열역학 제 1법칙 본문
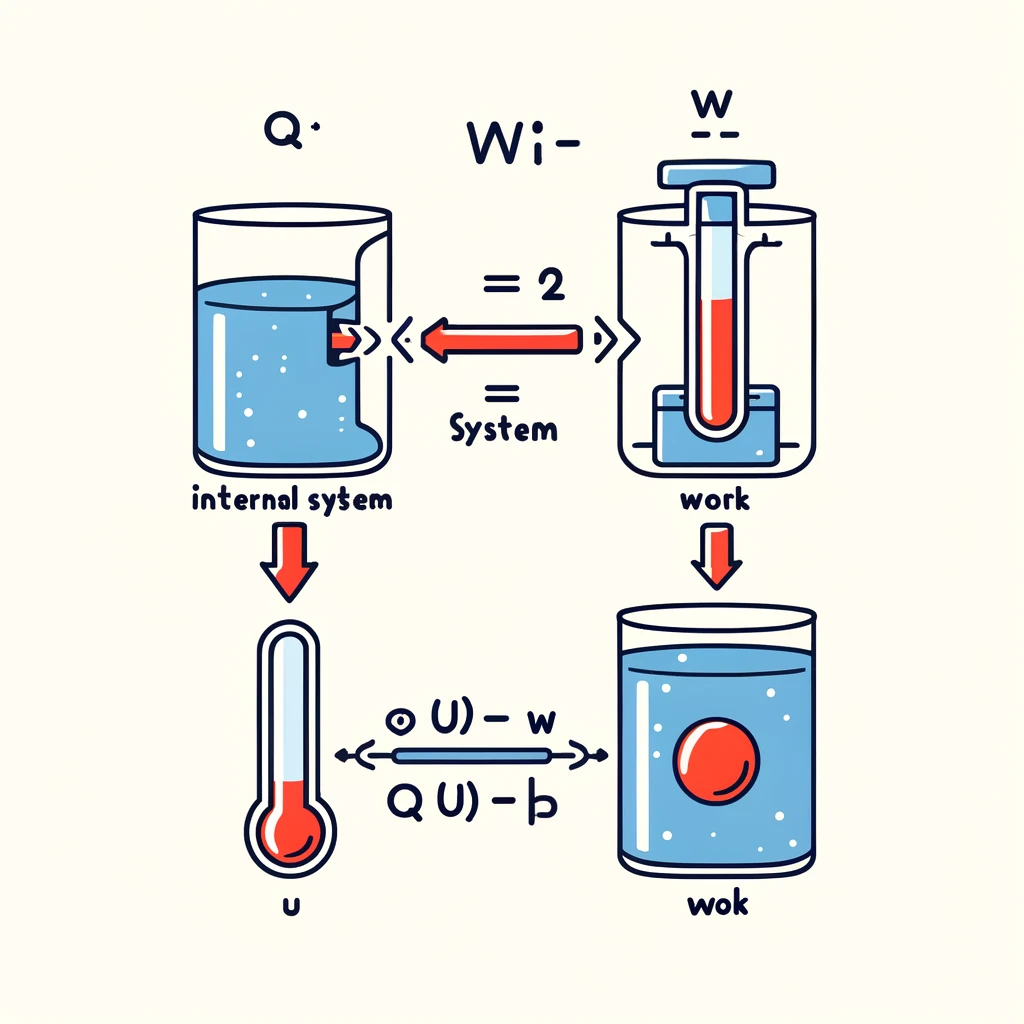
열역학 제1법칙은 에너지 보존 법칙을 열역학적 시스템에 적용한 것으로, 일반적으로 "에너지는 생성되거나 소멸될 수 없으며, 단지 한 형태에서 다른 형태로 변환될 뿐이다"라고 정의됩니다. 이 법칙은 열과 일이 어떻게 에너지 전환에 관여하는지 설명하며, 다양한 열역학적 과정에서 중요한 역할을 합니다.
정의
열역학 제1법칙은 다음과 같은 수학적 형식으로 표현할 수 있습니다:
$ \Delta U = Q - W $
여기서:
- $ \Delta U $ 는 시스템의 내부 에너지 변화량입니다.
- $ Q $ 는 시스템이 주변 환경으로부터 받은 열의 양입니다.
- $ W $ 는 시스템이 한 일의 양입니다.
의미
이 법칙은 열이 시스템에 추가되면 내부 에너지가 증가하고, 시스템이 주변에 일을 할 때 내부 에너지가 감소한다는 것을 나타냅니다. 이는 열과 일이 에너지의 두 가지 형태로, 시스템의 에너지 상태에 직접적인 영향을 미칩니다.
예시
- 열기관: 열기관에서 연료의 화학적 에너지가 열로 변환되고, 이 열은 다시 기계적 에너지(일)로 변환됩니다. 이 모든 과정은 제1법칙을 따릅니다.
- 냉장고: 냉장고는 외부에서 전기 에너지를 받아 내부의 낮은 온도를 유지하면서 열을 외부로 옮깁니다. 이 과정에서 사용되는 전기 에너지는 시스템 내에서 열을 이동시키는 데 사용되며, 이는 열역학 제1법칙의 예시입니다.
적용
열역학 제1법칙은 공학, 화학, 물리학, 생물학 등 거의 모든 과학 분야에서 중요합니다. 이 법칙은 에너지가 어떻게 이동하고 변환되는지 이해하는 데 필수적이며, 에너지 효율적인 기술을 개발하는 데도 중요한 역할을 합니다.
P-V 그래프

P-V 그래프, 즉 압력-부피 그래프는 기체의 상태 변화를 나타내는 데 매우 유용한 도구입니다. 이 그래프는 기체의 압력 $ P $ 와 부피 $ V $ 간의 관계를 시각적으로 보여주며, 열역학적 과정을 이해하는 데 중요한 역할을 합니다.
P-V 그래프의 기본 형태
P-V 그래프에서는 가로축에 부피, 세로축에 압력을 나타냅니다. 이상 기체의 행동을 다룰 때, 이 그래프는 기체의 다양한 열역학적 과정을 설명하는 데 사용됩니다. 몇 가지 기본적인 과정들을 살펴보겠습니다:
- 등온 과정 (Isothermal Process): 온도가 일정할 때, 기체의 P-V 그래프는 하이퍼볼릭(쌍곡선) 형태를 보입니다. 보일의 법칙에 따라 압력과 부피는 반비례 관계를 가지므로, 한 변수가 증가하면 다른 하나는 감소합니다.
- 등압 과정 (Isobaric Process): 압력이 일정할 때, 기체의 부피가 증가하면 온도도 증가합니다(샤를의 법칙). 이 경우, 그래프는 수평선을 그립니다.
- 등적 과정 (Isochoric Process): 부피가 일정할 때, 기체의 압력은 온도와 직접 비례합니다. P-V 그래프에서 이 과정은 수직선을 형성합니다.
- 단열 과정 (Adiabatic Process): 열이 시스템과 주변 사이에 전달되지 않을 때, 기체의 압력과 부피는 특정한 비례 관계를 가집니다. 단열 곡선은 등온 곡선보다 더 가파르게 나타납니다.
P-V 그래프의 응용
P-V 그래프는 엔진의 사이클, 압축기의 작동, 또는 기타 열기계 시스템의 분석에 중요하게 사용됩니다. 예를 들어, 카르노 사이클이나 오토 사이클 같은 기본적인 열기관 사이클은 P-V 그래프를 통해 설명되며, 이를 통해 엔진의 효율성을 평가할 수 있습니다.
기체분자 운동
기체의 상태 변화를 시각적으로 이해하고, 실제 열역학적 과정을 모델링하는 데 있어 P-V 그래프는 강력한 도구입니다. 이를 통해 과학자와 엔지니어는 기체의 행동을 더 잘 이해하고, 효율적인 기계와 시스템을 설계할 수 있습니다.
기체 분자 운동론은 기체의 물리적 성질을 기체를 구성하는 분자들의 운동과 상호 작용을 통해 설명하는 이론입니다. 이 이론은 19세기에 제임스 클러크 맥스웰과 루트비히 볼츠만 등의 물리학자들에 의해 발전되었으며, 기체 분자가 끊임없이 무작위적으로 움직이며 충돌한다는 가정을 기반으로 합니다. 이 이론은 열역학과 통계역학의 중요한 부분을 형성하며, 기체의 압력, 온도, 부피와 같은 매크로스코픽한 성질을 분자의 마이크로스코픽한 운동으로부터 설명할 수 있게 해줍니다.
기본 가정
기체 분자 운동론은 다음과 같은 몇 가지 기본 가정을 포함합니다:
- 분자의 운동: 기체 분자들은 끊임없이 무작위적이고 직선적으로 움직이며, 서로 또는 용기의 벽과 충돌합니다.
- 분자의 크기: 분자들의 크기는 그들이 차지하는 공간에 비해 매우 작으며, 대부분의 기체의 부피는 분자들 사이의 빈 공간으로 구성됩니다.
- 탄성 충돌: 분자들 사이 또는 분자와 용기 벽 사이의 모든 충돌은 완전히 탄성적이어서 에너지와 운동량이 보존됩니다.
- 분자 간의 상호작용: 분자들 사이에는 장거리 상호작용이 없으며, 오직 충돌 시에만 상호작용합니다.
- 속도의 분포: 분자들은 서로 다른 속도를 가지며, 이는 맥스웰-볼츠만 분포에 의해 정량적으로 설명됩니다.
주요 결과
- 압력과 온도의 관계: 기체의 압력은 분자들이 용기의 벽에 미치는 힘의 결과이며, 이 힘은 분자의 운동량 변화와 관련이 있습니다. 온도는 분자의 평균 운동 에너지와 직접적으로 비례하며, 이상 기체 상태 방정식 $ PV = nRT $ 를 통해 매크로스코픽하게 연결됩니다.
- 분자 속도의 분포: 맥스웰-볼츠만 속도 분포는 기체 분자의 속도가 어떻게 분포하는지를 설명하며, 가장 가능성이 높은 속도, 평균 속도, 그리고 중간 속도를 제공합니다.
응용
기체 분자 운동론은 화학 반응의 속도 이론, 확산, 열 전도, 점성, 물질의 상태 변화와 같은 현상을 이해하는 데 널리 사용됩니다. 이 이론은 물리학뿐만 아니라 화학, 생물학, 공학 등 다양한 분야에서 기초적이고 필수적인 도구로 활용됩니다.
'과학 Library' 카테고리의 다른 글
| 지구의 빙하기 (0) | 2024.04.17 |
|---|---|
| 파동의 물리량과 기본 식 (0) | 2024.04.16 |
| 이상기체와 보일 샤를의 법칙 (1) | 2024.04.15 |
| 열 역학 (0) | 2024.04.15 |
| 토크(돌림힘) (0) | 2024.04.15 |





